Questões de Química - Equilíbrio Químico para Concurso
Foram encontradas 267 questões
Ano: 2023
Banca:
CESPE / CEBRASPE
Órgão:
FUB
Prova:
CESPE / CEBRASPE - 2023 - FUB - Técnico de Laboratório - Área: Química |
Q2235111
Química
Texto associado
Em uma rotina de laboratório, foi construída uma curva de
calibração para quantificação do corante rodamina
B (C28H31ClN2O3) por espectroscopia UV-VIS em uma solução
preparada anteriormente e armazenada no laboratório. O técnico
preparou uma solução padrão estoque a 1.000 mg/L em pH = 3,
utilizando um padrão sólido comercial certificado. A partir dela,
foram preparados, por diluição, 5 padrões de 50 mL, nas
concentrações de 10 mg/L, 20 mg/L, 30 mg/L, 40 mg/L e
50 mg/L, para as leituras no espectrofotômetro. Para correção de
pH, o técnico tinha à disposição soluções de hidróxido de sódio e
ácido clorídrico a 0,01 mol/L. No laboratório, estavam
disponíveis, entre outros, os seguintes equipamentos e vidrarias:
balança analítica, balança semianalítica, pipetas e micropipetas
diversas, balões volumétricos, provetas, cubetas de vidro,
espectrofotômetro UV-VIS, ph-metro, eletrodo combinado de
vidro e água destilada.
Considerando essa situação hipotética e os múltiplos aspectos a ela relacionados, julgue o item a seguir.
Como as soluções de hidróxido de sódio e ácido clorídrico foram destinadas apenas para correção de pH e, portanto, não precisam ser padronizadas, é adequado prepará-las pesando-se os reagentes comerciais correspondentes em balança semianalítica.
Como as soluções de hidróxido de sódio e ácido clorídrico foram destinadas apenas para correção de pH e, portanto, não precisam ser padronizadas, é adequado prepará-las pesando-se os reagentes comerciais correspondentes em balança semianalítica.
Ano: 2023
Banca:
CESPE / CEBRASPE
Órgão:
FUB
Prova:
CESPE / CEBRASPE - 2023 - FUB - Técnico de Laboratório - Área: Química |
Q2235110
Química
Texto associado
Em uma rotina de laboratório, foi construída uma curva de
calibração para quantificação do corante rodamina
B (C28H31ClN2O3) por espectroscopia UV-VIS em uma solução
preparada anteriormente e armazenada no laboratório. O técnico
preparou uma solução padrão estoque a 1.000 mg/L em pH = 3,
utilizando um padrão sólido comercial certificado. A partir dela,
foram preparados, por diluição, 5 padrões de 50 mL, nas
concentrações de 10 mg/L, 20 mg/L, 30 mg/L, 40 mg/L e
50 mg/L, para as leituras no espectrofotômetro. Para correção de
pH, o técnico tinha à disposição soluções de hidróxido de sódio e
ácido clorídrico a 0,01 mol/L. No laboratório, estavam
disponíveis, entre outros, os seguintes equipamentos e vidrarias:
balança analítica, balança semianalítica, pipetas e micropipetas
diversas, balões volumétricos, provetas, cubetas de vidro,
espectrofotômetro UV-VIS, ph-metro, eletrodo combinado de
vidro e água destilada.
Considerando essa situação hipotética e os múltiplos aspectos a ela relacionados, julgue o item a seguir.
Para ser utilizado na aferição do pH das soluções, o ph-metro deve ser calibrado com, pelo menos, um padrão de calibração comercial, de preferência na região de pH alvo da solução a ser aferida.
Para ser utilizado na aferição do pH das soluções, o ph-metro deve ser calibrado com, pelo menos, um padrão de calibração comercial, de preferência na região de pH alvo da solução a ser aferida.
Ano: 2023
Banca:
CESPE / CEBRASPE
Órgão:
FUB
Prova:
CESPE / CEBRASPE - 2023 - FUB - Técnico de Laboratório - Área: Química |
Q2235077
Química
No que concerne a volumetria, gravimetria e potenciometria, julgue o item a seguir.
Situação hipotética: Um minério contendo magnetita (Fe3O4) foi analisado pela dissolução de uma amostra em HCl concentrado, o que resultou em uma mistura de Fe2+ e Fe3+. Depois de adicionado HNO3 para oxidar o Fe2+ a Fe3+, a solução resultante foi diluída com água e todo o Fe3+ foi precipitado como Fe(OH)3 pela adição de NH4OH. Após filtragem e enxágue, o resíduo foi calcinado, resultando em Fe2O3 puro. Assertiva: Nesse caso, a massa de Fe3O4 presente na amostra é corretamente calculada multiplicando-se por 2/3 a massa de Fe2O3 obtida ao final do processo.
Situação hipotética: Um minério contendo magnetita (Fe3O4) foi analisado pela dissolução de uma amostra em HCl concentrado, o que resultou em uma mistura de Fe2+ e Fe3+. Depois de adicionado HNO3 para oxidar o Fe2+ a Fe3+, a solução resultante foi diluída com água e todo o Fe3+ foi precipitado como Fe(OH)3 pela adição de NH4OH. Após filtragem e enxágue, o resíduo foi calcinado, resultando em Fe2O3 puro. Assertiva: Nesse caso, a massa de Fe3O4 presente na amostra é corretamente calculada multiplicando-se por 2/3 a massa de Fe2O3 obtida ao final do processo.
Ano: 2023
Banca:
CESPE / CEBRASPE
Órgão:
FUB
Prova:
CESPE / CEBRASPE - 2023 - FUB - Técnico de Laboratório - Área: Química |
Q2235075
Química
No que concerne a volumetria, gravimetria e potenciometria, julgue o item a seguir.
Situação hipotética: Dois ácidos monopróticos, um forte e um fraco, têm a mesma concentração e o mesmo volume inicial e foram titulados com uma mesma solução de NaOH. O gráfico a seguir mostra as curvas de titulação desses dois ácidos monopróticos.
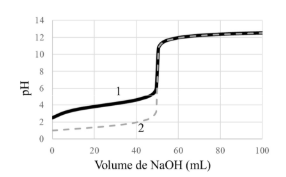
Assertiva: No gráfico, a curva 1 representa a titulação do ácido fraco.
Situação hipotética: Dois ácidos monopróticos, um forte e um fraco, têm a mesma concentração e o mesmo volume inicial e foram titulados com uma mesma solução de NaOH. O gráfico a seguir mostra as curvas de titulação desses dois ácidos monopróticos.

Assertiva: No gráfico, a curva 1 representa a titulação do ácido fraco.
Ano: 2023
Banca:
CESPE / CEBRASPE
Órgão:
FUB
Prova:
CESPE / CEBRASPE - 2023 - FUB - Técnico de Laboratório - Área: Química |
Q2235074
Química
No que concerne a volumetria, gravimetria e potenciometria, julgue o item a seguir.
Na titulação de um ácido monoprótico cuja constante de dissociação ácida seja Ka = 1 × 10−4, o indicador ácido-base escolhido terá o melhor rendimento se tiver pKa = 4.
Na titulação de um ácido monoprótico cuja constante de dissociação ácida seja Ka = 1 × 10−4, o indicador ácido-base escolhido terá o melhor rendimento se tiver pKa = 4.