Questões de Química - Sistemas Homogêneos: Constantes: Kc e Kp. Deslocamento do Equilíbrio: Fatores. para Concurso
Foram encontradas 244 questões
Um frasco contém uma mistura em equilíbrio de X2(g) e X atômico, segundo a reação:
X2(g) ⇌ 2 X(g)
A pressão de equilíbrio encontrada foi de 2,4 atm em certa condição de temperatura e volume. Se X2 gasoso a
uma pressão parcial de 3 atm for adicionado à mistura em equilíbrio acima, a volume e temperatura constantes,
a nova pressão de equilíbrio será de 5,66 atm, sendo que, no processo, a pressão do X (g) atômico aumenta
65% em relação ao valor da condição inicial. Nestas condições, assinale a opção que mostra O VALOR MAIS
PRÓXIMO DE Kp para a decomposição de X2(g), na mesma temperatura:
Figura: Curvas dos valores de frações em mol para: ácido carbônico - linha pontilhada; bicarbonato - linha tracejada; carbonato - linha sólida.
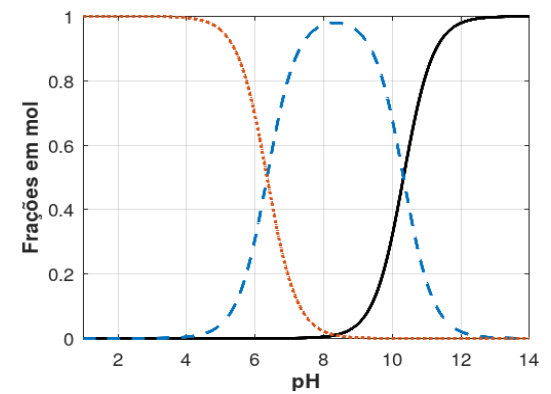
A partir das informações acima e sabendo que o Kps (constante produto de solubilidade) do CaCO3(s) (Calcita) é 4,5 x 10-9 , a 25°C , assinale a opção que mostra o valor aproximado da SOLUBILIDADE MOLAR deste carbonato, em pH 10: Dados eventualmente necessários:√4,5 = 2,12; √6,25 = 2,5; √3 = 1,73; √5 = 2,24; √10 = 3,16; √20 = 4,47.