Questões de Química - Sistemas Homogêneos: Solubilidade dos Sais, Hidrólise dos Sais e Curvas de Titulação. para Concurso
Foram encontradas 31 questões
Considerando as informações apresentadas, julgue o item subsequente.
Se a concentração dos íons Fe+2 dissolvidos em 50 mL da
água emulsionada for de 0,05 g/L, então o volume de água a
ser adicionado à emulsão para que essa concentração se torne
0,025 g/L é de 10 mL.
PbSO4 (s) ⇌ Pb2+(aq) + SO2–4 (aq)
A constante de equilíbrio (Kps) para essa reação é conhecida e equivale a 1,0 × 10−8 . Com base no equilíbrio iônico de solubilidade, a concentração máxima de íons de chumbo (Pb²⁺) na água tratada antes que o PbSO₄ comece a precipitar será de:
Situação hipotética: Um minério contendo magnetita (Fe3O4) foi analisado pela dissolução de uma amostra em HCl concentrado, o que resultou em uma mistura de Fe2+ e Fe3+. Depois de adicionado HNO3 para oxidar o Fe2+ a Fe3+, a solução resultante foi diluída com água e todo o Fe3+ foi precipitado como Fe(OH)3 pela adição de NH4OH. Após filtragem e enxágue, o resíduo foi calcinado, resultando em Fe2O3 puro. Assertiva: Nesse caso, a massa de Fe3O4 presente na amostra é corretamente calculada multiplicando-se por 2/3 a massa de Fe2O3 obtida ao final do processo.
Situação hipotética: Dois ácidos monopróticos, um forte e um fraco, têm a mesma concentração e o mesmo volume inicial e foram titulados com uma mesma solução de NaOH. O gráfico a seguir mostra as curvas de titulação desses dois ácidos monopróticos.
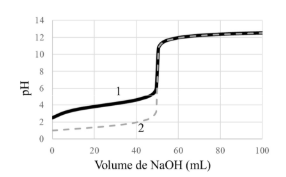
Assertiva: No gráfico, a curva 1 representa a titulação do ácido fraco.
Na sequência o iodo foi titulado com tiossulfato de sódio a 0,100 mol/L até o ponto final, com o gasto de 30,00 mL de titulante. Esta última reação foi: I2 + 2 S2O2-3(aq) ➝ 2 I-(aq) + S4O2-6(aq).
Diante das informações, assinale a opção que mostra A PORCENTAGEM EM MASSA DE ZINCO NA AMOSTRA de latão: Dados: massas molares (g/mol): Cu = 63,5; Zn = 65,4.