Questões de Química - Termodinâmica: Energia Interna, Trabalho, Energia Livre de Gibbs e Entropia para Concurso
Foram encontradas 92 questões

Internet:<www.tabelaperiodica.org>
Em relação à termodinâmica química, julgue o item.
Toda transformação isocórica ocorre com pressão
constante.
https://www.ecycle.com.br/bom-ou-ruim-usado-como-conservante-em-vinhos-dioxido-de-enxofrepode-causar-reacoes-alergicas/ (adaptado) acessado:2109/2023.
Ao se atacar 1,04 kg de sulfito de magnésio, com ácido clorídrico, qual o volume de anidrido sulfuroso obtido a 27°C e 1869 mmHg?
Em um laboratório, foram realizadas quatro réplicas de uma análise de cromo em uma liga metálica, obtendo-se os seguintes valores: 14 mg g-1 , 10 mg g-1 , 16 mg g-1 e 12 mg g-1 .
Para esse conjunto de dados, o desvio-padrão, em mg g-1 , encontra-se na faixa entre
Baseado no tamanho e no grau de espalhamento de luz incidente, calculou-se em 1 × 10-5 mol L-1 a concentração de AgNP na dispersão. A partir do tamanho médio, determinou-se que haveria 500 átomos de Ag por nanopartícula.
Considerando-se esses dados, verifica-se que a massa de prata, em mg, presente em 1 mL de dispersão é
Dado 1 mol = 6 x 1023 unidades M (Ag) = 108 g mol-1
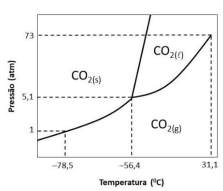
(*diagrama não desenhado em escala)
A partir das informações apresentadas avalie se as afirmativas a seguir são verdadeiras (V) ou falsas (F).
( ) Sob a condição de 5,1 atm e –56,40C prevalece o equilíbrio entre as fases sólida e gasosa.
( ) Sob a condição de 1,0 atm e –78,50C ocorre o ponto crítico para dióxido de carbono.
( ) Sob a condição de 73,0 atm e 31,1 atm ocorre o ponto de sublimação do dióxido de carbono.
As afirmativas são, respectivamente,