Questões de Concurso Público UFPI 2023 para Técnico de Laboratório - Química
Foram encontradas 3 questões
Figura: Dados cinéticos para uma reação de primeira ordem. Concentração versus tempo e velocidade versus tempo.
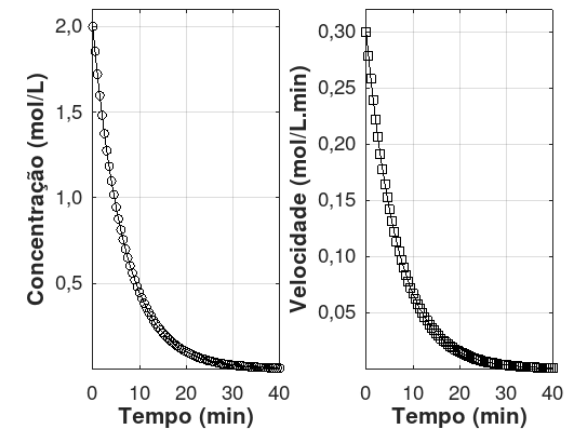
A partir da interpretação dos gráficos mostrados acima, assinale a opção que mostra corretamente O VALOR DO TEMPO DE MEIA-VIDA do processo, em minutos, com precisão de duas casas decimais: Dado: considere ln(2) = 0,693.
Dados eventualmente necessários: constante universal dos gases ideais, R = 8,314 J/mol.K = 2 cal/mol.K; ln(3) = 1,1; (276)-1 = 0,0036; (293)-1 = 0,0034; (313)-1 = 0,0032.
Tabela: Dados obtidos na investigação cinética (método da velocidade inicial) para a reação: 2 A2B(g) → 2 A2(g) + B2(g).
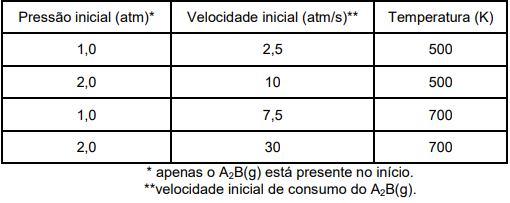
Diante das informações acima, assinale a opção que mostra A VELOCIDADE DA REAÇÃO (em termos de consumo do A2B(g)), em atm/s, quando a pressão de A2B(g) é igual a 1,5 atm à temperatura de 600 K: