Questões de Concurso Público UFPI 2023 para Técnico de Laboratório - Química
Foram encontradas 4 questões
Ano: 2023
Banca:
COPESE - UFPI
Órgão:
UFPI
Prova:
COPESE - UFPI - 2023 - UFPI - Técnico de Laboratório - Química |
Q2210795
Química
O termo “superácido” é usado para descrever os ácidos mais fortes do que o ácido sulfúrico, um dos ácidos
comuns mais fortes. George Andrew Olah (1927 - 2017), um químico húngaro-estadunidense, ganhou o Prêmio
Nobel de Química em 1994, com a aplicação de superácidos ao estudo de carbocátions. A água é um solvente
incapaz de distinguir os superácidos do ácido sulfúrico, uma vez que ela apresenta o chamado “efeito nivelador”.
Portanto, na quantificação da acidez dos superácidos é comum o uso da função de acidez de Hammett, H0, que
é definida matematicamente como:
H0 = pKa(BH+) - log [BH+] / [B]
onde B é um indicador básico, BH+ é o ácido conjugado desse indicador e pKa(BH+) é a constante de acidez deste último. Quando o indicador é nitroanilina (C6H6N2O2), experimentos realizados para ácidos puros nas mesmas condições, permitem construir a tabela abaixo:
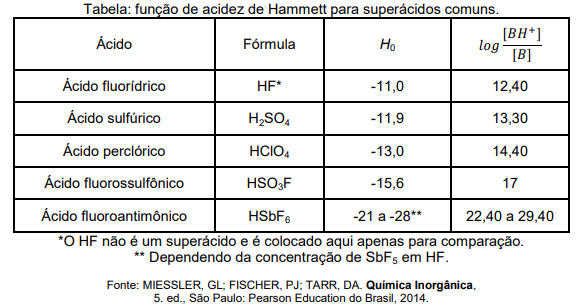
Diante dessas informações, assinale a opção que mostra a ÚNICA reação termodinamicamente espontânea entre pares das substâncias citadas acima:
H0 = pKa(BH+) - log [BH+] / [B]
onde B é um indicador básico, BH+ é o ácido conjugado desse indicador e pKa(BH+) é a constante de acidez deste último. Quando o indicador é nitroanilina (C6H6N2O2), experimentos realizados para ácidos puros nas mesmas condições, permitem construir a tabela abaixo:

Diante dessas informações, assinale a opção que mostra a ÚNICA reação termodinamicamente espontânea entre pares das substâncias citadas acima:
Ano: 2023
Banca:
COPESE - UFPI
Órgão:
UFPI
Prova:
COPESE - UFPI - 2023 - UFPI - Técnico de Laboratório - Química |
Q2210796
Química
O hidróxido de zinco, Zn(OH)2, por ser um importante precursor do óxido de zinco, ZnO, tem diversas aplicações
em diferentes áreas. Algumas das principais incluem a produção de cosméticos e protetores solares e a
vulcanização da borracha. Esse hidróxido é insolúvel em água, com constante produto de solubilidade, Kps, igual
a 1,2 x 10-17
, a 25 °C.
Diante das informações, assinale a opção que mostra o valor do pH (após o equilíbrio) de uma solução em que são adicionados 0,01 mol/L de Zn2+ e 0,02 mol/L de OH- , a 25 °C: Dados eventualmente necessários: Kw (H2O), a 25 °C = 1,00 x 10-14; (3)1/3 = 1,44; log (1,44) = 0,16; log (2,88) = 0,46; (6)1/2 = 2,45; log (2,45) = 0,39; log (4,9) = 0,69.
Diante das informações, assinale a opção que mostra o valor do pH (após o equilíbrio) de uma solução em que são adicionados 0,01 mol/L de Zn2+ e 0,02 mol/L de OH- , a 25 °C: Dados eventualmente necessários: Kw (H2O), a 25 °C = 1,00 x 10-14; (3)1/3 = 1,44; log (1,44) = 0,16; log (2,88) = 0,46; (6)1/2 = 2,45; log (2,45) = 0,39; log (4,9) = 0,69.
Ano: 2023
Banca:
COPESE - UFPI
Órgão:
UFPI
Prova:
COPESE - UFPI - 2023 - UFPI - Técnico de Laboratório - Química |
Q2210804
Química
A autoionização da água é um processo muito importante, pois dependendo da sua posição de equilíbrio
químico, define-se a acidez (ou alcalinidade) das soluções aquosas. Através de experimentos de condutividade
elétrica da água pura e da sua condutância específica, é possível determinar o grau de ionização da água e,
posteriormente, a constante de equilíbrio, Kw, da reação de autoionização. A 25 °C, o valor de Kw é 1,00 x 10-14
.
Por outro lado, para a água pura, a 37 °C, o grau de ionização é 73% maior, tendo em vista que a autoionização
da água é endotérmica. Vale ressaltar que nesta variação de temperatura a concentração molar da água é
praticamente invariável.
Diante das informações e a partir dos seus conhecimentos, assinale a opção que mostra aproximadamente O VALOR DO pOH de uma solução de pH 8,50, a 37 °C:
Dados: densidade da água = 1000 g/L; massa molar da água = 18 g/mol; log(1,73) = 0,24; log(3) = 0,48.
Diante das informações e a partir dos seus conhecimentos, assinale a opção que mostra aproximadamente O VALOR DO pOH de uma solução de pH 8,50, a 37 °C:
Dados: densidade da água = 1000 g/L; massa molar da água = 18 g/mol; log(1,73) = 0,24; log(3) = 0,48.
Ano: 2023
Banca:
COPESE - UFPI
Órgão:
UFPI
Prova:
COPESE - UFPI - 2023 - UFPI - Técnico de Laboratório - Química |
Q2210814
Química
Um técnico de laboratório encontrou um frasco contendo um sólido com a seguinte informação, “indicador ácido
(Ka = 5,0 x 10-5
)”. Consultando um manual de soluções disponível, o técnico informou-se de que o indicador em
questão apresenta duas colorações distintas em meio aquoso, dependendo se ele está na sua forma “protonada”
ou “desprotonada”, sendo elas AMARELA e AZUL, respectivamente. Diante das informações, assinale a opção
que mostra o VALOR DE pH, no qual uma solução do indicador se apresentará com coloração VERDE:
Dado eventualmente necessário: log(5) = 0,70.