Questões de Concurso Público SEE-PE 2016 para Professor de Química
Foram encontradas 7 questões
Em um laboratório foi montada uma aparelhagem para recolhimento do gás oxigênio produzido na reação de decomposição do clorato de potássio, como ilustra a figura a seguir.
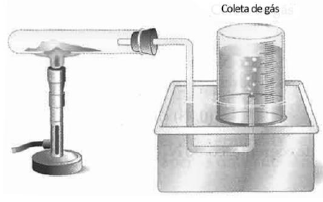
A reação observada pode ser representada pela equação:
2 KClO3 → 2 KCl+ 3 O2
Uma amostra de clorato de potássio foi parcialmente decomposta sendo a pressão do gás recolhido de 0,8 atm e seu volume de 180 mL na temperatura de 27ºC. Considerando o comportamento ideal do gás, a massa de clorato de potássio que sofreu decomposição foi de, aproximadamente,
Dados: Massa Molar: KClO3 = 122,5 g.mol-1
Constante real dos gases R= 0,082atm.L.mol-1 .K-1
 )
) Esta reação, descoberta pelo químico francês Paul Sabatier, tem sido estudada para remover CO2 de atmosferas artificiais como em espaçonaves. Considerando que um indivíduo libere para o ambiente 0,6 kg de dióxido de carbono por dia, e que 80% desse gás será removido pelo processo de Sabatier, a massa de metano produzida por dia é de Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
O fósforo é absorvido pelas plantas na forma de ânions; um desses ânions é o (H2PO4 )- derivado da fluorapatita, encontrada em rochas.
A fluorapatita, representada como Ca5 (PO4 )3F, é insolúvel em água e é convertida a di-hidrogenofosfato de cálcio através da reação não balanceada:
Ca5 (PO4 )3F (s) + H2SO4 (aq) → Ca(H2PO4)2 (aq) + CaSO4 (aq) + HF (g)
A soma dos menores coeficientes inteiros que balanceiam esta
equação é
A análise da concentração de ortofosfato em corpos d’água pode ser feita utilizando o método colorimétrico. Nesse método, o reagente combinado contendo K(SbO)C4H4O6, (NH4)6Mo7O24 e ácido ascórbico reage em meio ácido com o ortofosfato, produzindo uma cor azul, cuja intensidade é determinada no espectrofotômetro.
No preparo de 100 mL do reagente combinado utiliza-se 5 mL de uma solução de K(SbO)C4H4O6 3,5 g.L-1 e 15 mL de uma solução de (NH4)6Mo7O24 40 g.L-1.
Nessa solução do reagente combinado as concentrações
aproximadas (em g.L-1 ) de K(SbO)C4H4O6 e de (NH4)6Mo7O24 são,
respectivamente,
 : 74,5; BaSO4: 233
: 74,5; BaSO4: 233