Questões de Vestibular de Química - Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday.
Foram encontradas 420 questões

(P) NaCl
(Q) CaCO3
(R) H3 PO4
(S) SiO2 (I) produção de vidros (II) composição de xarope de bebida refrigerante (III) correção das condições do solo para plantio (IV) produção eletrolítica de soda cáustica
A associação mais correta dos itens da primeira coluna com os da segunda seria
Os metais são materiais sólidos, opacos e bons condutores de calor e eletricidade. Podem também ser transformados em lâminas, sendo usados para fabricar embalagens, como o cobre, o estanho e o alumínio. Recipientes de alumínio são usados para acondicionar bebidas como cervejas, sucos, refrigerantes etc. A produção desses recipientes de alumínio segue um longo caminho, desde a extração do minério (bauxita) até a sua prensagem, quando voltam para a fundição para serem reciclados. O quadro mostra um resumo do processo de produção de latas de alumínio.
Minério → Beneficiamento → Eletrólise → Fundição → Laminação → Latas → Consumidor → Coleta → Prensagem
MUNHOZ, D.; MAFRA, N.; BAGGIO, A. E. A evolução da embalagem: informações para uma
nova geração de consumidores conscientes. Belo Horizonte: ECO, 2007 (adaptado).
Considerando o quadro, a etapa na qual o minério é transformado em alumínio puro é a
Células a combustível são opções viáveis para gerar energia elétrica para motores e outros dispositivos. O esquema representa uma dessas células e as transformações que nela ocorrem.
H2(g) + ½ O2(g) → H2O(g) ΔH = -240kJ/mol de H2
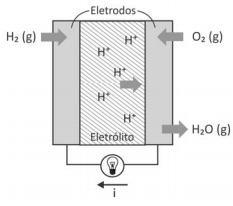
A corrente elétrica (i), em ampère (coulomb por segundo), gerada por uma célula a combustível que opera por 10 minutos e libera 4,80 kJ de energia durante esse período de tempo, é
Note e adote:
Carga de um mol de elétrons = 96.500 coulom
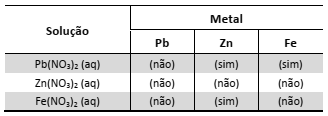
Um estudante realizou um experimento para avaliar a reatividade dos metais Pb, Zn e Fe. Para isso, mergulhou, em separado, uma pequena placa de cada um desses metais em cada uma das soluções aquosas dos nitratos de chumbo, de zinco e de ferro. Com suas observações, elaborou a seguinte tabela, em que (sim) significa formação de sólido sobre a placa e (não) significa nenhuma evidência dessa formação:
A seguir, montou três diferentes pilhas galvânicas, conforme esquematizado.
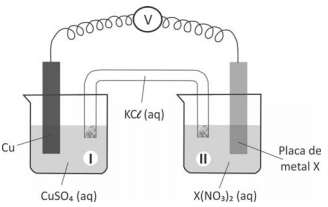
Nessas três montagens, o conteúdo do béquer I era uma solução aquosa de CuSO4 de mesma concentração, e essa solução era renovada na construção de cada pilha. O eletrodo onde ocorria a redução (ganho de elétrons) era o formado pela placa de cobre mergulhada em CuSO4 (aq).
Em cada uma das três pilhas, o estudante utilizou, no béquer II, uma placa de um dos metais X (Pb, Zn ou Fe), mergulhada na solução aquosa de seu respectivo nitrato.
O estudante mediu a força eletromotriz das pilhas, obtendo os valores: 0,44 V; 0,75 V e 1,07 V.
A atribuição correta desses valores de força eletromotriz a
cada uma das pilhas, de acordo com a reatividade dos metais
testados, deve ser