Questões de Vestibular de Química - Equilíbrio Químico
Foram encontradas 127 questões
Temperatura (°C) Kw pH 0 1,14 × 10–15 7,47 10 2,95 × 10–15 7,27 20 1,00 × 10–14 7,00 30 1,47 × 10–14 6,83 50 5,30 × 10–14 6,27
Analisando-se os dados, pode-se afirmar, corretamente, que a
Sabe-se pKa = - logKa = 7.20, em que Ka é a constante de dissociação do H2 PO4 - em água a 25 ºC.
O pH da primeira solução e a relação do pH da segunda solução com o pH da primeira são, respectivamente:
Um dos mais importantes processos industriais é a fixação do nitrogênio através de sua transformação em amônia, podendo ser representado pela equação a seguir:
N2
(g) + 3H2
(g)  2NH3(g) ΔH = - 92kJ.mol-1
2NH3(g) ΔH = - 92kJ.mol-1
Em relação a esse processo, haverá maior concentração do produto quando ocorrer
Cada estudante recebeu um recipiente contendo 800 mL de água destilada com algumas gotas do indicador de pH alaranjado de metila e soluções de HCl e NaOH em diversas concentrações.
Cada estudante deveria jogar apenas uma vez dois dados, um amarelo e um vermelho, ambos contendo os números de 1 a 6.
• Ao jogar o dado vermelho, o estudante deveria adicionar ao recipiente 100 mL de solução do ácido clorídrico na concentração 10−n mol/L,sendo n o número marcado no dado (por exemplo, se saísse o número 1 no dado, a solução seria de 10−1 mol/L; se saísse 6, a solução seria de 10−6 mol/L). • Ao jogar o dado amarelo, o estudante deveria executar o mesmo procedimento, mas substituindo o ácido por NaOH, totalizando assim 1,0 L de solução. • O estudante deveria observar a cor da solução ao final do experimento.
A professora mostrou a tabela com alguns valores de pH resultantes conforme os números tirados nos dados. Ela pediu, então, aos estudantes que utilizassem seus conhecimentos e a tabela para prever em quais combinações de dados a cor final do indicador seria vermelha.
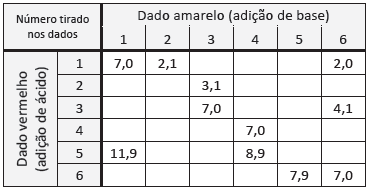
A probabilidade de, após realizar o procedimento descrito, a solução final preparada por um estudante ser vermelha é de:
Note e adote:
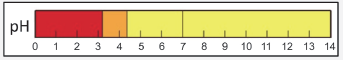
Considere a seguinte relação entre pH do meio e coloração do indicador alaranjado de metila:
Menor que 3,3 3,3 a 4,4 Maior que 4,4 Vermelho Laranja Amarelo
Considere as quatro reações químicas em equilíbrio apresentadas abaixo.
I H2 (g) + I2 (g) ⇋ 2 HI (g)
II 2 SO2 (g) + O2 (g) ⇋ 2 SO3 (g)
III CO (g) + NO2 (g) ⇋ CO2 (g) + NO (g)
IV 2 H2O (g) ⇋ 2 H2(g) + O2 (g)
Após submetê-las a um aumento de pressão, o deslocamento do equilíbrio gerou aumento
também na concentração dos produtos na seguinte reação: