Questões de Vestibular de Química - Equilíbrio Químico
Foram encontradas 632 questões
N2 O4 (g) ⇌ 2 NO2 (g)
A partir de um experimento, foram registradas as variações das concentrações desses óxidos em função do tempo. Observe o gráfico:
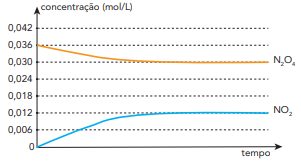
Com base nos dados obtidos, o valor da constante de equilíbrio em função das concentrações é igual a:
Considerando as informações do texto apresentado, julgue o item a seguir.
Considere que, no tratamento da água com hipoclorito de sódio, ocorra a seguinte reação, que tem constante de equilíbrio Kb = 1,0 × 10−7.
ClO− (aq) + H2O(l) ⇌ HClO(aq) + OH− (aq)
Nessa situação, em uma solução aquosa em que essa reação ocorre a pH = 6, a quantidade de mols de HClO é igual à quantidade de mols de ClO− no equilíbrio.
Leia o texto para responder às questões de 13 a 15. A produção de vinhos tem se desenvolvido nas últimas décadas em diversas regiões do Brasil. As características do vinho dependem de vários fatores, como condições de plantio (viticultura), processo de fermentação (vinificação) e compostos químicos participantes nessas etapas. Na viticultura, o óxido de cálcio (CaO) é usado para a correção do pH do solo, e o gesso agrícola ((CaSO4,2H2O é utilizado como fonte de cálcio e enxofre. Na vinificação, as uvas são prensadas e misturadas a leveduras, microrganismos que promovem a fermentação dos açúcares de acordo com a equação não balanceada:
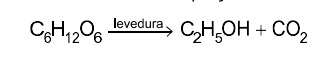
Durante o processo de vinificação, adiciona-se dióxido de enxofre (SO2,) para bloquear a ação de enzimas oxidantes. Alguns compostos orgânicos responsáveis pelo aroma e sabor do vinho estão representados pelas fórmulas estruturais de1 a 6.
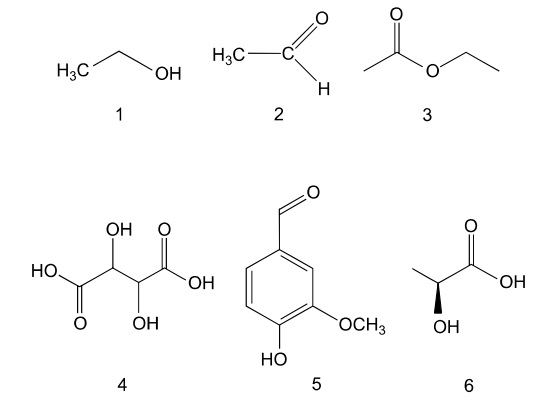

Os compostos de 1 a 6 foram testados quanto ao caráter ácido-base empregando-se o indicador azul de bromotimol, que apresenta cor amarela em soluções com pH < 6 e cor azul em soluções com pH > 7,6. Nesse teste, alíquotas de soluções aquosas de cada um dos compostos foram colocadas em tubos de ensaio numerados de acordo com o composto e, em seguida, foram adicionadas algumas gotas do indicador a cada um deles.
A coloração amarela foi observada nos tubos
DADOS QUE PODEM SER USADOS NESTA PROVA
