Questões de Vestibular de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 69 questões
Em 12 de maio de 2017 o Metrô de São Paulo trocou 240 metros de trilhos de uma de suas linhas, numa operação feita de madrugada, em apenas três horas. Na solda entre o trilho novo e o usado empregou-se uma reação química denominada térmita, que permite a obtenção de uma temperatura local de cerca de 2.000 °C. A reação utilizada foi entre um óxido de ferro e o alumínio metálico. De acordo com essas informações, uma possível equação termoquímica do processo utilizado seria
O livro O Pequeno Príncipe, de Antoine de Saint-Exupéry, uma das obras literárias mais traduzidas no mundo, traz ilustrações inspiradas na experiência do autor como aviador no norte da África. Uma delas, a figura (a), parece representar um chapéu ou um elefante engolido por uma jiboia, dependendo de quem a interpreta.
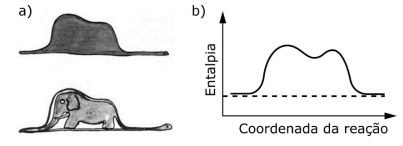
Para um químico, no entanto, essa figura pode se
assemelhar a um diagrama de entalpia, em função da
coordenada da reação (figura b). Se a comparação for
válida, a variação de entalpia dessa reação seria
Analise os três diagramas de entalpia.
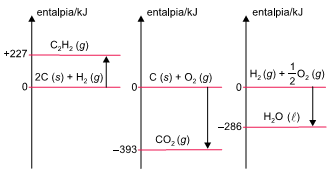
O ∆H da combustão completa de 1 mol de acetileno, C2H2 (g), produzindo CO2 (g) e H2O (ℓ) é
Considerando a equação de formação da glicose não balanceada C + H2 + O2 → C6H12O6 , atente às seguintes equações:
I. C + O2 → CO2 ΔH = −94,1 kcal
II. H2 + ½ O2 → H2O ΔH = −68,3 kcal
III. C6H12O6 + 6O2 → 6CO2 + 6 H2O ΔH = −673,0 kcal
A massa de glicose formada a partir da reação de 14,4 g de carbono e sua entalpia de formação em kcal/mol serão, respectivamente,
