Questões de Vestibular de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 341 questões
A produção de muitos dos alimentos e bebidas mais apreciados envolve processos fermentativos. A produção do vinho e da cerveja, realizada com auxílio do Saccharomyces cerevisiae, é um exemplo. Esse micro-organismo é capaz de alimentar-se de açúcares simples, como a glicose, produzindo etanol e dióxido de carbono, como mostra a equação química não balanceada a seguir.
C6 H12O6 → CH3 CH2 OH + CO2
Sobre esse assunto, é correto afirmar que
Sob certas condições, tanto o gás flúor quanto o gás cloro podem reagir com hidrogênio gasoso, formando, respectivamente, os haletos de hidrogênio HF e HCℓ, gasosos. Podese estimar a variação de entalpia (ΔH) de cada uma dessas reações, utilizandose dados de energia de ligação. A tabela apresenta os valores de energia de ligação dos reagentes e produtos dessas reações a 25 °C e 1 atm.
Molécula H2 F2 Cℓ2 HF HCℓ
Energia de ligação (kJ/mol) 435 160 245 570 430
Com base nesses dados, um estudante calculou a variação de entalpia (ΔH) de cada uma das reações e concluiu, corretamente, que, nas condições empregadas,
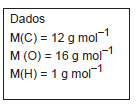
O benzeno reage completamente com oxigênio, conforme indicado na equação:
2 C6 H6 (l) + 15 O2 (g) → 12 CO2 (g) + 6 H2O (g); ∆H° = -6.600 kJ
Um volume, em mL, de benzeno foi reagido em excesso de oxigênio produzindo -132 kJ de energia. Se a densidade do benzeno é 0,88 g mL-1 , o volume do hidrocarboneto mais próximo daquele que reagiu foi
Dado
M (C6
H6
) = 78,0 g mol-1
I - A vaporização do etanol é um processo exotérmico.
II - Os produtos de uma reação de combustão têm entalpia inferior aos reagentes.
III- A reação química da cal viva (óxido de cálcio) com a água é um processo em que ocorre absorção de calor.
Quais estão corretas?