Questões de Vestibular UEPB 2009 para Vestibular, QUÍMICA E FÍSICA - 2º DIA
Foram encontradas 6 questões
Durante décadas, o DDT(dicloro-difenil-tricloroetano) foi largamente usado como inseticida até ser comprovado que, além de provocar câncer, demora de 4 a 30 anos para se degradar. O DDT foi utilizado na Segunda Guerra Mundial para prevenção de tifo em soldados, que o utilizavam também para o combate a piolhos. Posteriormente foi usado na agropecuária, no Brasil e no mundo, dado seu baixo preço e elevada eficiência. Especialistas afirmam que o principal problema do DDT é sua ação indiscriminada, que atinge tanto as pragas quanto o resto da fauna e flora da área afetada. O DDT também se infiltra na água, contaminando os mananciais.

I - O DDT foi utilizado na Segunda Guerra Mundial como arma química devido ao efeito mortífero que esta substância provoca aos seres humanos causando sua morte por febre tifóide.
II - O DDT é uma substância muito instável. Mesmo a temperatura ambiente, ele sofre degradação térmica resultando no produto DDE.
III - O DDE apresenta quatro átomos de cloro e oito átomos de hidrogênio em sua estrutura.
IV - O DDT apresenta átomo de carbono assimétrico e, por conseqüência, atividade óptica.
Estão ERRADOS
Durante décadas, o DDT(dicloro-difenil-tricloroetano) foi largamente usado como inseticida até ser comprovado que, além de provocar câncer, demora de 4 a 30 anos para se degradar. O DDT foi utilizado na Segunda Guerra Mundial para prevenção de tifo em soldados, que o utilizavam também para o combate a piolhos. Posteriormente foi usado na agropecuária, no Brasil e no mundo, dado seu baixo preço e elevada eficiência. Especialistas afirmam que o principal problema do DDT é sua ação indiscriminada, que atinge tanto as pragas quanto o resto da fauna e flora da área afetada. O DDT também se infiltra na água, contaminando os mananciais.

Durante décadas, o DDT(dicloro-difenil-tricloroetano) foi largamente usado como inseticida até ser comprovado que, além de provocar câncer, demora de 4 a 30 anos para se degradar. O DDT foi utilizado na Segunda Guerra Mundial para prevenção de tifo em soldados, que o utilizavam também para o combate a piolhos. Posteriormente foi usado na agropecuária, no Brasil e no mundo, dado seu baixo preço e elevada eficiência. Especialistas afirmam que o principal problema do DDT é sua ação indiscriminada, que atinge tanto as pragas quanto o resto da fauna e flora da área afetada. O DDT também se infiltra na água, contaminando os mananciais.

Desde eras remotas o ser humano extrai da natureza corantes, numa busca incessante pela diversidade de cores. São exemplos, o índigo, extraído da planta Indigofera tinctoria, e a brasileína, da Caesalpinia echinata (pau-brasil), entre muitos outros extraídos de vegetais. No entanto, poucas substâncias de origem animal foram utilizadas como corantes têxteis. Apesar disso, os corantes vermelhos provenientes de insetos, o quermes e a cochinilha, foram muito apreciados. Por exemplo, o Império Romano valorizava-os tanto que era um dos tributos que as nações conquistadas tinham de pagar. O imperador Nero chegou a punir com a morte o uso da púrpura de Tiro, corante obtido a partir de espécies de um molusco do género Murex.
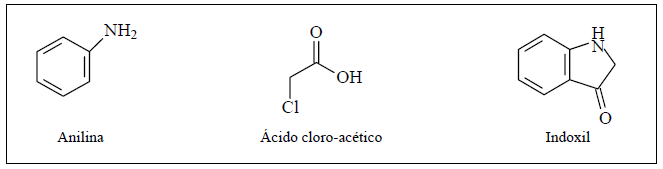
Sabendo que as estruturas planares dos compostos anilina, ácido cloro-acético e indoxil são apresentadas abaixo, qual a estrutura plana da N-fenil-glicina?
Desde eras remotas o ser humano extrai da natureza corantes, numa busca incessante pela diversidade de cores. São exemplos, o índigo, extraído da planta Indigofera tinctoria, e a brasileína, da Caesalpinia echinata (pau-brasil), entre muitos outros extraídos de vegetais. No entanto, poucas substâncias de origem animal foram utilizadas como corantes têxteis. Apesar disso, os corantes vermelhos provenientes de insetos, o quermes e a cochinilha, foram muito apreciados. Por exemplo, o Império Romano valorizava-os tanto que era um dos tributos que as nações conquistadas tinham de pagar. O imperador Nero chegou a punir com a morte o uso da púrpura de Tiro, corante obtido a partir de espécies de um molusco do género Murex.
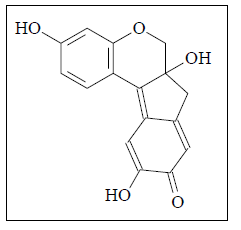
Um dos corantes do pau-brasil é a brasileína, com fórmula estrutural plana apresentada ao lado. Esta substância é colorida, pois possui varias ligações π conjugadas e um anel aromático em sua estrutura. Quantos elétrons π (pi) e quantas ligações σ (sigma) existem nesta molécula?