Questões de Vestibular CAMPO REAL 2018 para Vestibular Medicina
Foram encontradas 6 questões
Nos processos hidrometalúrgicos de obtenção do cobre metálico a partir da calcopirita (CuFeS2), os componentes desse minério são inicialmente separados utilizando-se solução aquosa de cloreto férrico (FeCl3), como indicado pela seguinte equação:
CuFeS2 (s) + 4 Fe+3 (aq.) → Cu+2 (aq.) + 5 Fe+2 (aq.) + 2 S (s)
Sabendo que o número de oxidação do cobre na calcopirita é +2, considere as seguintes afirmativas a respeito da ação redox dos reagentes da equação apresentada:
1. O S-2 (aq.) é o agente oxidante.
2. O Fe+3 (aq.) é o agente oxidante.
3. O CuFeS2 (s) é o agente redutor.
4. O Cu+2 (aq.) é o agente redutor.
Assinale a alternativa correta.
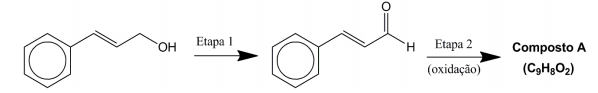
Com relação ao assunto, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) O composto mostrado como matéria-prima para a síntese do cinamaldeído é um fenol. ( ) A Etapa 1 é uma oxidação. ( ) O produto formado na Etapa 2 é uma cetona. ( ) A estrutura apresentada para o cinamaldeído representa o isômero trans.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
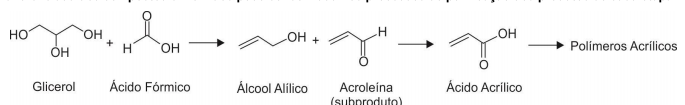
Assinale a alternativa que apresenta somente compostos que reagem com solução aquosa de bicarbonato de sódio, gerando gás carbônico.
Considere: O sistema adiabático, uma combustão completa a 1200 oC e que os gases gerados são gases ideais. Dados: R = 0,082 atm.L.K-1 .mol-1 ; Massa Molar (C6H12O6) = 180 g/mol.
A pressão interna do recipiente no momento exato da combustão da amostra é de:
Dados: Massas atômicas (g/mol): Enxofre = 32,06; Cálcio = 40,08; Oxigênio = 16,00
Considerando os dados apresentados, qual é a massa de óxido de cálcio (em gramas) necessária para o preparo de 50 litros da solução que será usada no pomar de peras?