Questões de Concurso Militar EsPCEx 2016 para Cadete do Exército - 1° Dia
Foram encontradas 44 questões
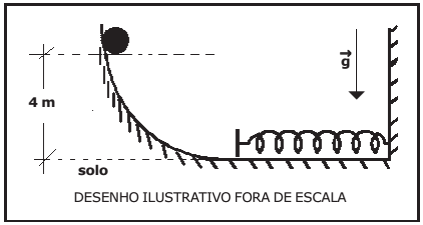
Uma esfera, sólida, homogênea e de massa 0,8 kg é abandonada de um ponto a 4 m de altura do solo em uma rampa curva.
Uma mola ideal de constante elástica k=400 N/m é colocada no fim dessa rampa, conforme desenho abaixo. A esfera colide com a mola e provoca uma compressão.
Desprezando as forças dissipativas, considerando a intensidade da aceleração da gravidade g = 10 m/s2 e que a esfera apenas desliza e não rola, a máxima deformação sofrida pela mola é de:
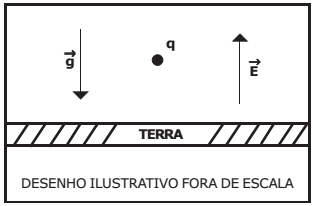
Uma partícula de carga q e massa 10-6 kg foi colocada num ponto próximo à superfície da Terra onde existe um campo elétrico uniforme, vertical e ascendente de intensidade E=105 N/C. Sabendo que a partícula está em equilíbrio, considerando a intensidade da aceleração da gravidade g=10 m/s2, o valor da carga q e o seu sinal são respectivamente:
O cobre metálico pode ser oxidado por ácido nítrico diluído, produzindo água, monóxido de nitrogênio e um sal (composto iônico). A reação pode ser representada pela seguinte equação química (não balanceada):
Cu (s) + HNO3 (aq) → H2O (l) + NO (g) + Cu(NO3)2 (aq)
A soma dos coeficientes estequiométricos (menores números inteiros) da equação balanceada,
o agente redutor da reação e o nome do composto iônico formado são, respectivamente,
O propan-2-ol (álcool isopropílico), cuja fórmula é C3H8O, é vendido comercialmente como álcool de massagem ou de limpeza de telas e de monitores. Considerando uma reação de combustão completa com rendimento de 100% e os dados de entalpias padrão de formação (∆Hof ) das espécies participantes desse processo e da densidade do álcool, a quantidade de energia liberada na combustão completa de 10,0 L desse álcool será de

Em análises quantitativas, por meio do conhecimento da concentração de uma das espécies, pode-se determinar a concentração e, por conseguinte, a massa de outra espécie. Um exemplo, é o uso do nitrato de prata (AgNO3) nos ensaios de determinação do teor de íons cloreto, em análises de água mineral. Nesse processo ocorre uma reação entre os íons prata e os íons cloreto, com consequente precipitação de cloreto de prata (AgCl) e de outras espécies que podem ser quantificadas.
Analogamente, sais que contêm íons cloreto, como o cloreto de sódio (NaCl), podem ser usados na determinação quantitativa de íons prata em soluções de AgNO3 , conforme descreve a equação:
AgNO3 + NaCl → AgCl + NaNO3
Para reagir estequiometricamente, precipitando na forma de AgCl, todos os íons prata presentes em 20,0 mL de solução 0,1 mol·L-1 de AgNO3(completamente dissociado), a massa necessária de cloreto de sódio será de:
Dados: Massas atômicas: Na = 23 u; Cl = 35,5 u; Ag = 108 u; N = 14 u; O = 16 u.