No contexto do início do século XX, quando o espectro de ra...
Próximas questões
Com base no mesmo assunto
Ano: 2021
Banca:
IBFC
Órgão:
SEED - RR
Prova:
IBFC - 2021 - SEED - RR - Professor de Educação Básica - Física |
Q1951026
Física
No contexto do início do século XX, quando o
espectro de raias de emissão discreta de
radiação de diferentes elementos era
intensamente avaliado, o modelo de Bohr com
as transições eletrônicas modeladas em
termos da existência de órbitas discretas entre
as quais transitavam os elétrons dos átomos
(posteriormente descritos na teoria quântica
em sua forma moderna final em termos dos
orbitais eletrônicos) teve um esplêndido
sucesso em tratar do espectro do átomo de
hidrogênio.
No diagrama abaixo temos uma figura que
representa o espectro de emissão do átomo de
hidrogênio em termos da linguagem das séries
espectrais. São indicados os números
quânticos principais dos orbitais e o
comprimento de onda associado à radiação
emitida/absorvida na transição.
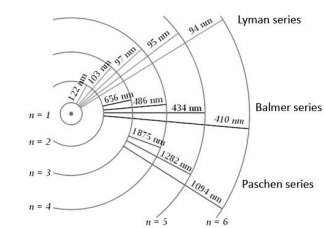
Fonte: https://commons.wikimedia.org/wiki/File:Hydrogen_transitions.svg
O conjunto de raias de emissão são classificados em séries com nome de seus descobridores e as primeiras transições rotuladas, respectivamente, em ordem crescente de energia entre os níveis eletrônicos envolvidos são rotulados por letras do alfabeto grego, em particular alpha e beta são as duas primeiras transições (de mais baixa energia) que resultam na emissão de fótons. Lembrando que o espectro visível se estende aproximadamente entre as faixas de 380 nm e 700 nm do comprimento de onda da radiação eletromagnética, analise as afirmativas abaixo, dê valores Verdadeiro (V) ou Falso (F).
( ) A transição alpha da série de Paschen é 1094nm e a alpha da série de Lyman é 94 nm. ( ) As transições alpha, beta e gamma de Paschen estão no ultravioleta. ( ) A transição alpha da série de Balmer tem comprimento de onda mais próximo do vermelho.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.

Fonte: https://commons.wikimedia.org/wiki/File:Hydrogen_transitions.svg
O conjunto de raias de emissão são classificados em séries com nome de seus descobridores e as primeiras transições rotuladas, respectivamente, em ordem crescente de energia entre os níveis eletrônicos envolvidos são rotulados por letras do alfabeto grego, em particular alpha e beta são as duas primeiras transições (de mais baixa energia) que resultam na emissão de fótons. Lembrando que o espectro visível se estende aproximadamente entre as faixas de 380 nm e 700 nm do comprimento de onda da radiação eletromagnética, analise as afirmativas abaixo, dê valores Verdadeiro (V) ou Falso (F).
( ) A transição alpha da série de Paschen é 1094nm e a alpha da série de Lyman é 94 nm. ( ) As transições alpha, beta e gamma de Paschen estão no ultravioleta. ( ) A transição alpha da série de Balmer tem comprimento de onda mais próximo do vermelho.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.