Questões de Vestibular de Química - Sistemas Homogêneos: Constantes: Kc e Kp. Deslocamento do Equilíbrio: Fatores.
Foram encontradas 229 questões
O gás nitrogênio (N2) reage com o gás oxigênio (O2), conforme a reação a seguir:
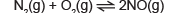
Considere que a constante de equilíbrio da reação é igual a 16 e que as concentrações de equilíbrio de N2 e O2 são, respectivamente, 02mol/L e 02mol/L.
Baseado nos conhecimentos sobre sistemas reversíveis, o valor da concentração molar de NO é igual a
As cavernas são formadas pela dissolução de carbonato de cálcio (CaCO3) em água. Esse sal é muito comum na natureza e pode ser encontrado em grande quantidade na constituição do calcário. Ele não é muito solúvel em água; no entanto, quando está na presença de dióxido de carbono (gás carbônico – CO2) e sendo submetido a altas pressões, o carbonato de cálcio se solubiliza bem na água. As águas subterrâneas se encontram exatamente nessas condições, isto é, com grande quantidade de gás carbônico dissolvido e a elevadas pressões. Assim, quando as águas subterrâneas passam por terrenos contendo calcário, ocorre a dissolução do carbonato de cálcio, conforme pode ser representado pela seguinte equação química:
CaCO3(s) + CO2(g) + H2O(ℓ) → Ca2+(aq) + 2HCO-3(aq) ΔH < 0
Entretanto, essa reação também pode ocorrer no sentido inverso, resultando na formação do calcário. Isso acontece, por exemplo, quando essas águas ficam no teto das cavernas e vão gotejando muito lentamente. Dessa forma, a água vai evaporando e também há a liberação do CO2(g), e o carbonato vai se depositando na forma de estalactites no teto e estalagmites no chão das cavernas.
Ca2+(aq) + 2 HCO-3(aq) → CaCO3(s) + CO2(g) + H2O(ℓ) ΔH > 0
Disponível em:<http://mundoeducacao.bol.uol.com.br/quimica/formacaoconstituicao-estalactites-estalagmites.htm> . Acesso em: 29 de julho de 2016.
2HI(g) ⇌ H2(g) + I2(g) ΔH° = − 53kJ
Uma análise dessas informações permite afirmar:
2H2(g) + O2(g)→ 2H2O(v)
Em um recipiente aberto, a água evapora até o fim, na temperatura e pressão ambiente. Entretanto, quando o recipiente é fechado, as moléculas de água são impedidas de escapar, ocorrendo, então, um equilíbrio de evaporação entre água líquida e vapor, a 25o°C e 1,0atm. Uma análise dessas informações permite corretamente concluir: