Questões de Química - Eletroquímica: Oxirredução, Potenciais Padrão de Redução, Pilha, Eletrólise e Leis de Faraday. para Concurso
Foram encontradas 617 questões
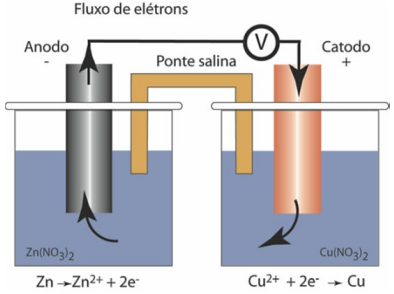
Como mostra a figura, a formação desse tipo de pilha é apenas uma das maneiras através da qual pode ser desencadeada a corrosão eletrolítica. A pilha de corrosão evidenciada acima ocorre devido à diferença de potencial de eletrodo entre os diferentes metais, e é mais reativa quanto maior for esta diferença de potencial. Esse tipo de pilha compreende um exemplo clássico das pilhas de corrosão eletroquímicas, que é conhecido por
As bactérias redutoras de sulfato (BRS) têm grande importância na biocorrosão. Embora, até o momento não exista a determinação de um mecanismo único de corrosão ocasionado pela ação das BRS, Kuhr e Vlug (1934) propuseram um mecanismo no qual essas bactérias utilizam o hidrogênio proveniente do consumo realizado pela hidrogenase, catalisando a ativação reversível de hidrogênio. Em condições anaeróbicas, essa reação de corrosão é a evolução de hidrogênio pela dissociação da água, em que os íons de hidrogênio produzidos se encontram adsorvidos sobre a superfície metálica, sendo posteriormente consumidos pelo processo metabólico, como mostra a figura abaixo:
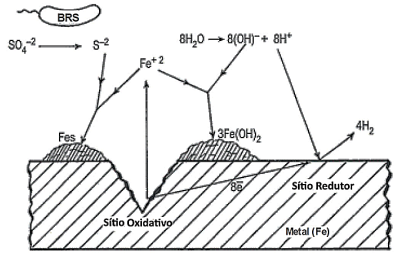
De acordo com o que mostra a figura e a descrição do mecanismo de corrosão supracitado, esse tipo de biocorrosão é classificado como
Julgue o próximo item, a respeito da equação de Nernst e de potencial de eletrodo, eletrodos indicadores e medidas de pH.
Potencial de eletrodo é a medida do potencial individual de
um eletrodo reversível no estado-padrão, ou seja, solutos em
concentração de 1 mol/kg e gases à pressão de 1 bar, ambos
a 273 K.
Julgue o próximo item, a respeito da equação de Nernst e de potencial de eletrodo, eletrodos indicadores e medidas de pH.
Para determinar a capacidade de um metal em atuar como anodo de sacrifício, é adequado montar um eletrodo com o referido metal, com potencial desconhecido, ligá-lo a um eletrodo de potencial conhecido e medir a diferença de potencial entre os eletrodos. Nesse contexto, pode-se usar, para a avaliação, um eletrodo de zinco metálico (Zn), que, em uma célula eletroquímica com solução 1 mol/L de ZnSO4, apresenta a seguinte semirreação no anodo.
Zn (s) → Zn2+ (aq) + 2 e−